Újabb eszköz a covid elleni küzdelemben
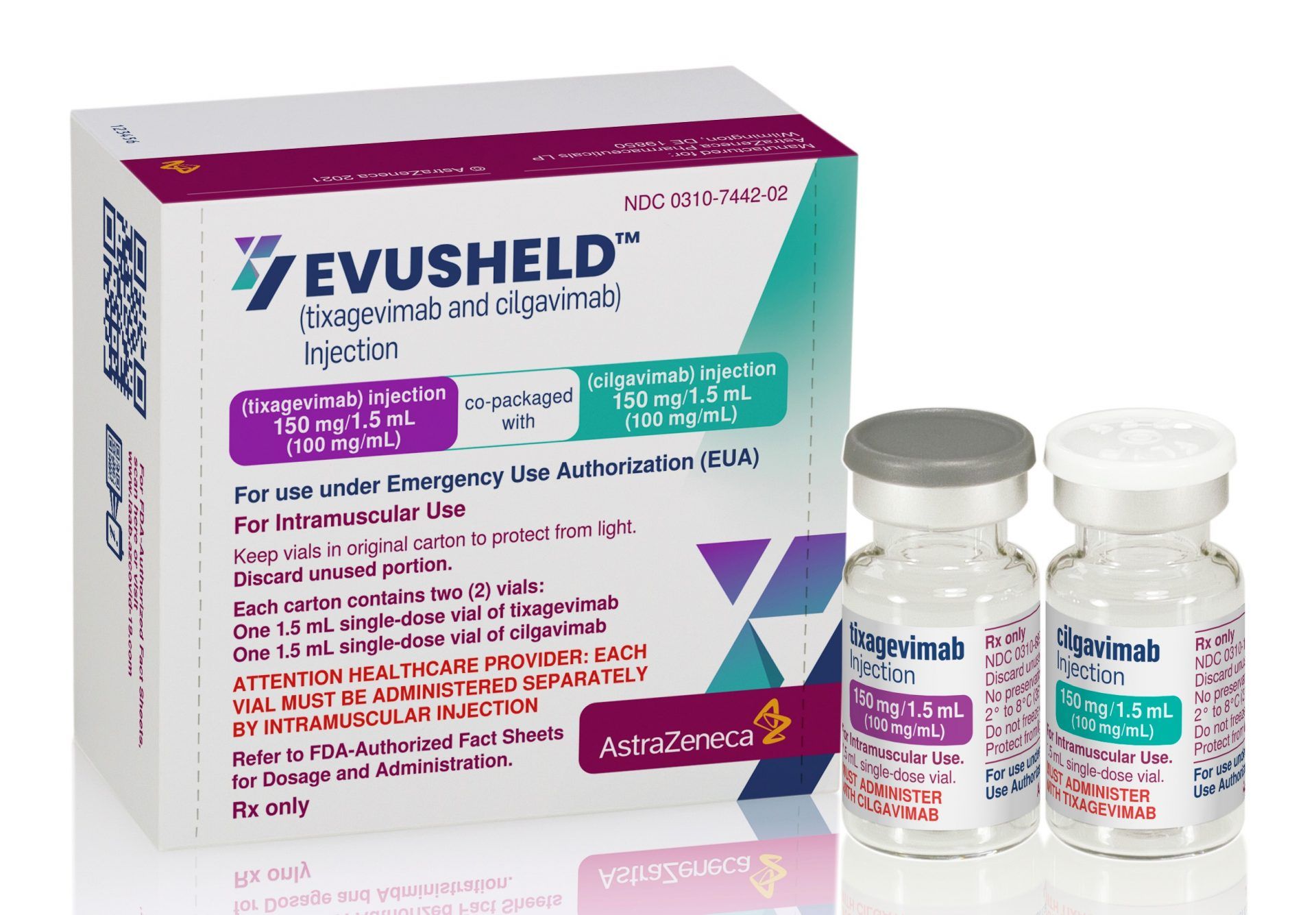
Engedélyezte az AstraZeneca Evusheld nevű gyógyszerét az Egyesült Államok gyógyszerhatósága (FDA) sürgősségi felhasználásra a koronavírus megelőzése céljából – olvasható a vállalat csütörtöki közleményében.
A készítmény egy olyan antitest kombináció, mely azokon segíthet, akiknek egészségi állapota vagy az immunrendszerét befolyásoló gyógyszeres kezelése miatt nem alakul ki megfelelő válasz a Covid-19 oltásra, valamint azok számára, akiknek a Covid-19 elleni védőoltás nem javasolt.
Az érintettek jelenleg nem lehetnek fertőzöttek SARS-CoV-2-vel, vagy a közelmúltban nem érintkezhettek fertőzött személlyel.
Mene Pangalos, az AstraZeneca kutatási vezérigazgató helyettese elmondta, hogy
büszkék vagyunk arra, hogy segíthetünk a COVID-19 világjárvány elleni küzdelemben, melynek részeként kifejlesztettük az Evusheld nevű gyógyszerünket, mely elsőként kapott engedélyt az USA-ban a COVID-19 betegség megelőzésére, mivel azonnali és hosszú időtartamú védelmet biztosít egyetlen beadott dózisban.
Pangalos szerint az Evusheld hatásos a koronavírus korábbi változataival szemben és jelenleg is folynak a vizsgálatok azon célból, hogy kiderüljön, működik-e a koronavírus omikron-variánsával szemben is.
Az Evusheld két hosszú hatású, módosított monoklonális antitest kombinációja, mely az egyetlen ilyen típusú készítmény, amit az Egyesült Államok gyógyszerhatósága a COVID-19 megelőzésére engedélyezett egy alkalommal izomba beadott injekció formájában.
Globálisan a népesség 2 százaléka tartozik abba a körbe, akiknél a védőoltás sem feltétlenül alakít ki megfelelő immunválaszt. Többek között közéjük tartoznak a rosszindulatú vérképzőszervi betegséggel élők, a kemoterápiával kezelt daganatos betegek, és a szervátültetés után lévők, vagy más immun-csökkentő kezelést kapó betegek (pl. a sclerosis multiplex vagy a sokízületi gyulladás miatti terápia).
Az engedélyezést megalapozó vizsgálatok szerint a védelem legalább hat hónapon át fennmarad.